 Å se cellekjernen i 4-D
Å se cellekjernen i 4-D
Evolution news; 15. juni 2018
Oversatt herfra.
Bilde1. 4-D eks. Kreditt: TheDigitalArtist, via Pixabay.
Vi vet om gener og genomer, og hvordan over seks fot av DNA er proppet inn i en liten kjerne i en celle. Tiår med detaljert forskning har gitt oss statisk, 3-D-visning av kjernen. Hva som er nytt er den frenetiske aktiviteten som skjer inni kjernen i det kromosomer beveger seg på plass og gener slår seg på og av. Tillegget av tidsdimensjonen gjør at vi får snapshots av genomet i en film, og det er en braksuksess.
To banebrytende artikler i Cell forklarer hvordan Caltech-forskere har kikket inn i live- transkripsjon av gener, og ser deler av genomet lyse opp når de blir aktive. Det de finner finner nye nivåer av design. Hvem kunne tenke på tilfeldighet etter å ha sett hva disse forskerne var vitne til?
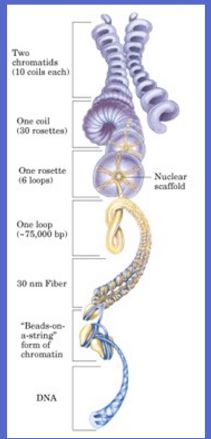 Kjerne organisering
Kjerne organisering
Den første artikkelen fra Quinodoz et al., "Higher Order Inter-Chromosomal Hubs Shape 3D Genome Organisation in the Nucleus" rapporterer om arbeid gjort i laben av Mitchell Guttman. Resultatene er oppsummert i nyhetene fra Caltech, " The Cartography of the Nucleus." -her, Legg merke til designimplikasjonene i åpnings-setningene:
--Plassert dypt i hver av cellene dine er det som ser ut som et magisk trick: Seks fot av DNA er pakket inn i et lite rom 50 ganger mindre enn bredden av et menneskehår. Som en lang, tynn streng av genetisk spagetti, blir denne DNA-blåkopien for hele kroppen foldet, vridd og komprimert for å passe inn i kjernen til hver celle.
Nå har Caltech-forskere vist hvordan celler organiserer det etter alt å dømme enorme genomet på en smart måte, slik at de lettvint kan finne og få tilgang til viktige gener.
Kjernelegemer er regioner der gener knytter seg til proteinmaskiner som vil transkribere og redigere dem. Ved siden av et roterende 3-D-bilde av kromosomer som knytter seg til nukleolus og andre kjernelegemer, beskriver nyhetsgruppen hvordan teamet utviklet et nytt bildeverktøy, kalt SPRITE, for å se hvordan gener slås på forskjellig i ulike typer celler.
--Selv om det store flertallet av celler i hver menneskekropp inneholder identiske genomer , kan forskjellige typer celler ha forskjellige funksjoner fordi gener kan uttrykkes på varierende nivåer - med andre ord kan de slås på eller av. For eksempel, når en stamcelle utvikler seg til et nevron, skjer en flom av aktivitet i kjernen for å sette opp og ned nivåer av genuttrykk. Disse nivåene ville være forskjellige, for eksempel hvis stamcellen ble til en muskelcelle, eller hvis cellen tok beslutningen om selvdestruksjon.
Deretter lærer vi om kjernelegemer. Legg merke til maskinspråket og effektiviteten: dette er raskt, presisjonsarbeid!
--I tillegg til genomet, inneholder kjernen også strukturer kalt nukleære kropper , som er lik miniatyrfabrikker i kjernen som inneholder en høy konsentrasjon av cellulære maskiner som alle arbeider for å utføre lignende oppgaver, for eksempel å slå på bestemte sett av gener eller modifisere RNA-molekyler å produsere proteiner i cellen. Dette cellulære maskineriet må effektivt kunne søke gjennom seks fot med DNA - omtrent 20.000 totale gener i pattedyr - for å finne og kontrollere sine mål nøyaktig. Dette gjøres mulig fordi DNA er organisert i tredimensjonale strukturer som gjør visse gener mer eller mindre tilgjengelige.
Figurer i artikkelen -her, viser faktisk en høy grad av organisasjon. SPRITE plasserer strekkode-etiketter på gener som tillater forskere å følge kromosomstrenger ettersom de organiserer kjernelegemer. Noen kjernelegemer, kalt nukleære flekker, er der genomisk DNA er organisert, og hvor RNA Polymerase II, spliseosomer og lncRNAer transkriberer og redigerer dem. Inaktive deler av kromosomet assosierer med nukleolus -her, som inneholder repressive proteiner på DNA som holder gener slått av. "Dessuten," sier de, "tyder våre resultater på at flere aktivt transkriberte DNA-regioner kan arrangere samtidig rundt nukleære flekker for å danne høyere ordens inter-kromosomale interaksjoner. ”
Sammen tyder disse resultatene på et integrert og globalt bilde av genom-organisasjon hvor individuelle genomiske regioner på tvers av kromosomer organiserer rundt kjernelegemer for å forme den samlede emballasjen av genomisk DNA på en svært regulert og dynamisk måte (figur 7).
 Quinodoz forklarer hva som er viktig med denne fremgangen:
Quinodoz forklarer hva som er viktig med denne fremgangen:
--"Med SPRITE, var vi i stand til å se tusenvis av molekyler - DNA og RNA - komme sammen på ulike 'nav' rundt kjernen i enkeltceller," sier Quinodoz, studiens første-forfatter. " Tidligere teoretiserte forskere at hvert kromosom på en måte er seg selv nok, og hadde sitt eget" territorium " i kjernen. Men nå ser vi at flere gener på forskjellige kromosomer klynger seg sammen rundt disse kroppene av cellulært maskineri. Vi tror at disse "navene" kan hjelpe cellen å holde DNA som er slått på eller av pent organisert i forskjellige deler av kjernen, slik at cellemaskineriet lett kan få tilgang til bestemte gener i kjernen."
Kjerne dynamikk
Den andre artikkelen , av Shah et al., Er oppsummert i dette fra Caltech, "Ten thousand Bursting Genes." -her. Dette teamet forbedret et eksisterende bildebehandlingsverktøy kalt seqFISH som tillot dem å se ikke bare fire eller fem gener, som tidligere, men 10.421 gener samtidig i individuelle celler ved å merke dem med fluorescerende strekkoder. Nyhetsobjektet viser tusenvis av fargede prikker i et kart over kjernen hvor gryende transkripsjon ble sett å forekomme.
Tidligere metoder fulgte messenger-RNAene, som har en lengre levetid. Ved å følge kortlivede introner i gener med sine koder, fant dette laget et formål bak disse mystiske, ikke-kodende regioner: (oversetters understreking)
--For at genetiske instruksjoner skal bli omdannet til et faktisk fungerende protein, må først en prosess kalt transkripsjon inntreffe. Denne prosessen skjer ofte i pulser, eller "utbrudd." Først vil et gen bli lest og kopiert til en forløper messenger-RNA , eller pre-mRNA, som å notere et raskt, grovt utkast. Dette molekylet modnes deretter til et messenger-RNA , eller mRNA, som er relatert til redigering av det grove utkastet. Under "redigeringsprosessen" kuttes bestemte regioner som kalles introner ut av pre-mRNA.
Teamet valgte å fokusere på merking av introner fordi de er produsert så tidlig i transkripsjonsprosessen, og gir et bilde av hva en celle gjør på det nøyaktige øyeblikket av genuttrykk.
å følge intronene førte til en oppdagelse at
--transkripsjonen av gener oscillerer globalt på tvers av mange gener på hva Cai kaller en "overraskende kort" tidsskala - bare omtrent to timer - sammenlignet med tiden det tar for en celle å dele og replikere seg selv, noe som tar fra 12 til 24 timer. Dette betyr at i løpet av en to-timers periode vil mange gener i en celle slås på og av.
Det var som å se et miniatyr-fyrverkeri i farger. Tagene avslører hva det "gryende transcriptomet" gjør, og gir en mer dynamisk oppløsning av nukleær aktivitet. Med denne forbedrede seqFISH-merketeknikken, kan forskere se hvordan transskripsjonsaktiviteten varierer mellom ulike typer celler.
 Teamet lærte også ting om kjerne-organisering. De var "overrasket over å oppdage at de fleste aktive proteinkodende gener ligger på overflaten av kromosomet, ikke begravet på innsiden av det." I tillegg er "transskripsjonelt aktive steder plassert på overflaten av kromosomområder". Dette er ikke 'spaghetti kode' inne i en basketball! ("Spaghetti-kode" var et begrep som varslet for dataprogrammer som sammen med "go-to" -signaler over alt, noe som gjør det vanskelig å følge. Dagens modulære programmering er bedre organisert. Cellen hadde det først!)
Teamet lærte også ting om kjerne-organisering. De var "overrasket over å oppdage at de fleste aktive proteinkodende gener ligger på overflaten av kromosomet, ikke begravet på innsiden av det." I tillegg er "transskripsjonelt aktive steder plassert på overflaten av kromosomområder". Dette er ikke 'spaghetti kode' inne i en basketball! ("Spaghetti-kode" var et begrep som varslet for dataprogrammer som sammen med "go-to" -signaler over alt, noe som gjør det vanskelig å følge. Dagens modulære programmering er bedre organisert. Cellen hadde det først!)
Arbeidet av Shah et al. kan føre til andre spennende funn. Til slutt ser de fremover:
--Ved hjelp av pulsatil og oscillerende dynamikk kan celler oppnå tilstander som ikke er tilgjengelige med amplitudebaserte reguleringssystemer (Letsou og Cai, 2016). For eksempel kan celler bruke fluktuasjoner i global transkripsjons-aktivitet for å koordinere støkiometrien -her til mange transkripsjoner i en mekanisme som er lik den frekvensmodulerte signalering observert i gjær og pattedyr-stier (Cai et al., 2008; Yissachar et al., 2008; 2013).
--Endelig viste et spennende nylig arbeid at intron-til-ekson forholdene over transkriptomet kan brukes til å bestemme retningen til [sic] celler på utviklings-stien (La Manno et al., 2017). Som vi viste, kan de gryende transkripsjonsprofilene ikke bare skille celletyper og celle-tilstander, men også oppdage rask dynamikk i enkeltceller. Anvendelser av intron seqFISH med signalforsterkning (Shah et al., 2016a) sammen med mRNA seq-FISH (Shah et al., 2016b, Lignell et al., 2017), kan muliggjøre samtidig profilering av spirende og modne RNA i vev, med romlig informasjon bevart. Det vil være fascinerende å utforske det gryende transkriptomet i enkeltceller i mange vevs- og utviklingsmessige sammenhenger.
Kort sagt, kunne celler dra nytte av den observerte to-timers svingningen for flere nivåer av koordinering og regulering. De kan bruke det som signaler lagt oppå en FM-radio bære-bølge!
Konklusjon
Det virkelig spennende arbeidet innen genetikk gjøres med et øye for design. Disse forskerne behøvde ikke å eksplisitt godkjenne intelligent design for å vise hvorfor dette er tilfelle. Budskapet om design kommer gjennom høyt og tydelig i spørsmålene de stiller, og i funnene som resulterer. Fraværet av evolusjonær spekulasjon forbedrer 'signal-til-støy' raten.
Tager: Cellen; DNA; kromosomet; gener; kjernen; RNA; transkripsjon.
Oversettelse og bilder ved Asbjørn E. Lund
 Å se cellekjernen i 4-D
Å se cellekjernen i 4-D Å se cellekjernen i 4-D
Å se cellekjernen i 4-D Kjerne organisering
Kjerne organisering Quinodoz forklarer hva som er viktig med denne fremgangen:
Quinodoz forklarer hva som er viktig med denne fremgangen: Teamet lærte også ting om kjerne-organisering. De var "overrasket over å oppdage at de fleste aktive proteinkodende gener ligger på overflaten av kromosomet, ikke begravet på innsiden av det." I tillegg er "transskripsjonelt aktive steder plassert på overflaten av kromosomområder". Dette er ikke 'spaghetti kode' inne i en basketball! ("Spaghetti-kode" var et begrep som varslet for dataprogrammer som sammen med "go-to" -signaler over alt, noe som gjør det vanskelig å følge. Dagens modulære programmering er bedre organisert. Cellen hadde det først!)
Teamet lærte også ting om kjerne-organisering. De var "overrasket over å oppdage at de fleste aktive proteinkodende gener ligger på overflaten av kromosomet, ikke begravet på innsiden av det." I tillegg er "transskripsjonelt aktive steder plassert på overflaten av kromosomområder". Dette er ikke 'spaghetti kode' inne i en basketball! ("Spaghetti-kode" var et begrep som varslet for dataprogrammer som sammen med "go-to" -signaler over alt, noe som gjør det vanskelig å følge. Dagens modulære programmering er bedre organisert. Cellen hadde det først!)